жҒ©з»ҙиҫҫ®пјҲжҒ©жІғеҲ©еҚ•жҠ—жіЁе°„ж¶Іпјӣз ”еҸ‘д»ЈеҸ·пјҡKN035пјү* жҳҜеә·е®Ғжқ°з‘һиҮӘдё»з ”еҸ‘зҡ„PD-L1еҚ•еҹҹжҠ—дҪ“FcиһҚеҗҲиӣӢзҷҪпјҢжҳҜе…Ёзҗғ第дёҖдёӘдё”зӣ®еүҚе”ҜдёҖиҺ·жү№дёҠеёӮзҡ„зҡ®дёӢжіЁе°„PD-(L)1жҠ—дҪ“пјҢд№ҹжҳҜдёӯеӣҪ第дёҖдёӘй’ҲеҜ№и·ЁзҳӨз§ҚйҖӮеә”з—Үзҡ„е…Қз–«жІ»з–—иҚҜзү©гҖҒйҰ–дёӘеӣҪдә§PD-L1иҚҜзү©гҖӮеҹәдәҺе…¶зӢ¬зү№и®ҫи®ЎпјҢеңЁжңүж•ҲжҖ§гҖҒе®үе…ЁжҖ§гҖҒдҫҝеҲ©жҖ§е’Ңдҫқд»ҺжҖ§ж–№йқўе…·жңүдјҳеҠҝпјҢжӮЈиҖ…ж— йңҖиҝӣиЎҢйқҷи„үж»ҙжіЁпјҢиғҪжһҒеӨ§ең°иҠӮзңҒеҢ»з–—иө„жәҗгҖӮзӣ®еүҚжӯЈеңЁдёӯеӣҪгҖҒзҫҺеӣҪе’Ңж—Ҙжң¬ејҖеұ•еӨҡдёӘиӮҝзҳӨйҖӮеә”з—Үзҡ„дёҙеәҠз ”з©¶пјҢеӨҡдёӘйҖӮеә”з—Үе·Іиҝӣе…ҘжіЁеҶҢ/в…ўжңҹдёҙеәҠгҖӮжҒ©з»ҙиҫҫ®пјҲжҒ©жІғеҲ©еҚ•жҠ—жіЁе°„ж¶Іпјүе·Іиў«зҫҺеӣҪFDAжҺҲдәҲжҷҡжңҹиғҶйҒ“зҷҢеӯӨе„ҝиҚҜиө„ж јгҖҒиҪҜз»„з»ҮиӮүзҳӨеӯӨе„ҝиҚҜиө„ж јгҖӮ2021е№ҙ11жңҲпјҢжҒ©з»ҙиҫҫ®еңЁдёӯеӣҪиҺ·жү№дёҠеёӮпјҢйҖӮз”ЁдәҺдёҚеҸҜеҲҮйҷӨжҲ–иҪ¬з§»жҖ§еҫ®еҚ«жҳҹй«ҳеәҰдёҚзЁіе®ҡпјҲMSI-HпјүжҲ–й”ҷй…Қдҝ®еӨҚеҹәеӣ зјәйҷ·еһӢпјҲdMMRпјүзҡ„жҲҗдәәжҷҡжңҹе®һдҪ“зҳӨжӮЈиҖ…зҡ„жІ»з–—гҖӮ
KN035 : жҷ¶дҪ“з»“жһ„
д»ҘеҫҖеёӮеңәдёҠзҡ„PD-(L)1жІ»з–—йңҖиҰҒйў‘з№ҒиҝӣиЎҢйқҷи„үж»ҙжіЁпјҢж—ўдёҚиғҪж»Ўи¶іжӮЈиҖ…з”ЁиҚҜзҡ„дҫҝжҚ·жҖ§йңҖжұӮпјҢд№ҹе°ҶеҪұе“ҚжӮЈиҖ…дҪҝз”ЁиҚҜзү©зҡ„дҫқд»ҺжҖ§гҖӮи¶ҠжқҘи¶ҠеӨҡзҡ„иӮҝзҳӨжӮЈиҖ…жңҹеҫ…жӣҙеҠ дҫҝжҚ·зҡ„PD-(L)1з–—жі•:
жҒ©з»ҙиҫҫ®пјҲжҒ©жІғеҲ©еҚ•жҠ—жіЁе°„ж¶Іпјӣз ”еҸ‘д»ЈеҸ·пјҡKN035пјүжҳҜе…ЁзҗғйҰ–дёӘиҺ·жү№дёҠеёӮзҡ„зҡ®дёӢжіЁе°„PD-L1жҠ‘еҲ¶еүӮпјҢжӮЈиҖ…еҸҜд»ҘеңЁ30з§’еҶ…е®ҢжҲҗз»ҷиҚҜпјҢе°Өе…¶йҖӮз”ЁдәҺдҪ“ејұгҖҒй«ҳйҫ„еҸҠжңүйқҷи„үиҫ“жіЁеҸҚеә”зҡ„жӮЈиҖ…пјҢе…·жңүеұ…家иҮӘдё»з»ҷиҚҜзҡ„жҪңеҠӣпјҢд»ҺиҖҢжӣҙеҘҪең°ж”№е–„жӮЈиҖ…зҡ„з”ҹжҙ»иҙЁйҮҸгҖӮ

ASCO 2020 posterпјҡжҒ©жІғеҲ©еҚ•жҠ—пјҲKN035пјүз”ЁдәҺй”ҷй…Қдҝ®еӨҚзјәйҷ·зҡ„жҷҡжңҹиӮҝзҳӨзҡ„дёҙеәҠж•°жҚ®
ASCO 2019 posterпјҡKN035еңЁж—Ҙжң¬жҷҡжңҹе®һдҪ“зҳӨжӮЈиҖ…дёӯзҡ„е®үе…ЁжҖ§е’ҢиҚҜд»ЈеҠЁеҠӣеӯҰз ”з©¶
ASCO 2019 posterпјҡKN035еңЁдёӯеӣҪжҷҡжңҹе®һдҪ“зҳӨжӮЈиҖ…дёӯзҡ„в… жңҹдёҙеәҠз ”з©¶
ESMO 2018 posterпјҡKN035пјҲдёҖз§Қж–°еһӢжҠ—PD-L1иһҚеҗҲжҠ—дҪ“пјүеңЁзҫҺеӣҪжҷҡжңҹе®һдҪ“зҳӨжӮЈиҖ…дёӯзҡ„в… жңҹдёҙеәҠз ”з©¶
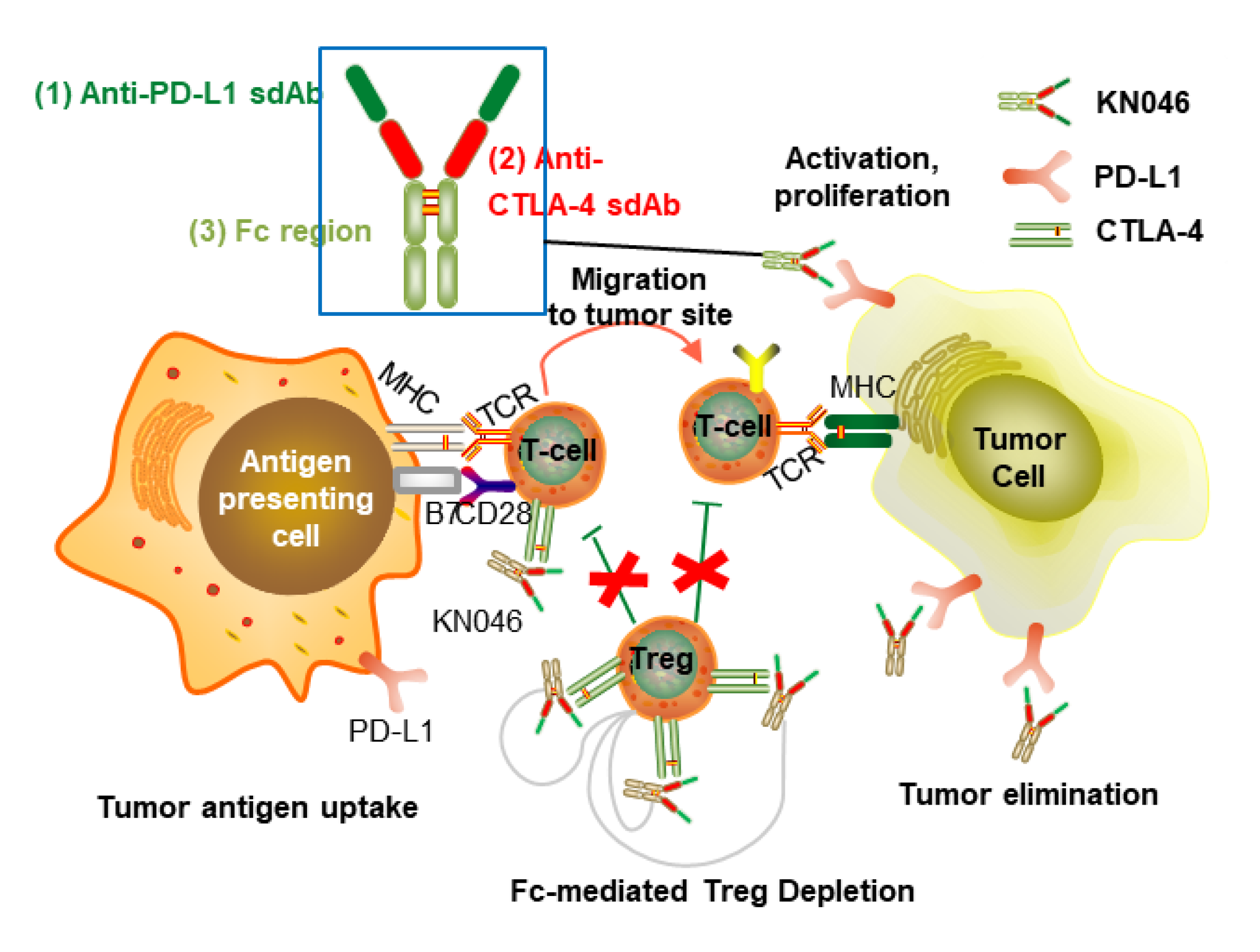
KN046жҳҜеә·е®Ғжқ°з‘һиҮӘдё»з ”еҸ‘зҡ„PD-L1/CTLA-4еҸҢзү№ејӮжҖ§жҠ—дҪ“пјҢе…¶еҲӣж–°и®ҫи®ЎеҢ…жӢ¬пјҡйҮҮз”ЁжңәеҲ¶дёҚеҗҢзҡ„CTLA-4дёҺPD-L1еҚ•еҹҹжҠ—дҪ“иһҚеҗҲз»„жҲҗпјҢеҸҜйқ¶еҗ‘еҜҢйӣҶдәҺPD-L1й«ҳиЎЁиҫҫзҡ„иӮҝзҳӨеҫ®зҺҜеўғеҸҠжё…йҷӨжҠ‘еҲ¶иӮҝзҳӨе…Қз–«зҡ„TregгҖӮ
 KN046 : жҷ¶дҪ“з»“жһ„
KN046 : жҷ¶дҪ“з»“жһ„KN046еңЁжҫіеӨ§еҲ©дәҡгҖҒзҫҺеӣҪе’ҢдёӯеӣҪе·ІејҖеұ•иҰҶзӣ–йқһе°Ҹз»ҶиғһиӮәзҷҢгҖҒиғ°и…әзҷҢгҖҒиғёи…әзҷҢгҖҒиӮқзҷҢгҖҒйЈҹз®ЎйіһзҷҢгҖҒдёүйҳҙд№іи…әзҷҢзӯү10дҪҷз§ҚиӮҝзҳӨзҡ„иҝ‘20йЎ№дёҚеҗҢйҳ¶ж®өдёҙеәҠиҜ•йӘҢпјҢиҜ•йӘҢз»“жһңжҳҫзӨәжӮЈиҖ…иҺ·еҫ—з”ҹеӯҳиҺ·зӣҠзҡ„дјҳеҠҝгҖӮзҫҺеӣҪFDAеҹәдәҺеңЁжҫіеӨ§еҲ©дәҡе’ҢдёӯеӣҪеҸ–еҫ—зҡ„дёҙеәҠиҜ•йӘҢз»“жһңпјҢжү№еҮҶKN046еңЁзҫҺеӣҪзӣҙжҺҘиҝӣе…Ҙв…ЎжңҹдёҙеәҠиҜ•йӘҢпјҢ并дәҺ2020е№ҙ9жңҲжҺҲдәҲKN046з”ЁдәҺжІ»з–—иғёи…әдёҠзҡ®иӮҝзҳӨзҡ„еӯӨе„ҝиҚҜиө„ж јгҖӮзӣ®еүҚKN046зҡ„еӨҡйЎ№жіЁеҶҢдёҙеәҠиҜ•йӘҢжӯЈеңЁиҝӣиЎҢдёӯпјҢе…¶дёӯKN046иҒ”еҗҲеҢ–з–—дёҖзәҝжІ»з–—йқһе°Ҹз»ҶиғһиӮәзҷҢзҡ„в…ўжңҹдёҙеәҠз ”з©¶жңҹдёӯеҲҶжһҗжҲҗеҠҹиҫҫеҲ°йў„и®ҫPFSз»ҲзӮ№гҖӮ
ESMO 2023 posterпјҡKN046еҜ№ж—ўеҫҖдёҖзәҝжІ»з–—еӨұиҙҘзҡ„еӨҚеҸ‘/иҪ¬з§»жҖ§иғёи…әзҷҢжӮЈиҖ…зҡ„еӨҡдёӯеҝғгҖҒеҚ•иҮӮв…ЎжңҹдёҙеәҠз ”з©¶
ESMO 2023 posterпјҡKN046иҒ”еҗҲйҳҝжҳ”жӣҝе°јдёҖзәҝжІ»з–—жҷҡжңҹйқһе°Ҹз»ҶиғһиӮәзҷҢзҡ„еҚ•иҮӮгҖҒејҖж”ҫж ҮзӯҫгҖҒеӨҡдёӯеҝғв…Ўжңҹз ”з©¶еҲқжӯҘж•°жҚ®
ESMO 2023 posterпјҡKN046з”ЁдәҺж—ўеҫҖжҺҘеҸ—иҝҮе…Қз–«жЈҖжҹҘзӮ№жҠ‘еҲ¶еүӮзҡ„иҪ¬з§»жҖ§йқһе°Ҹз»ҶиғһиӮәзҷҢжӮЈиҖ…зҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§з»“жһң
ESMO 2023 posterпјҡKN046з”ЁдәҺж—ўеҫҖEGFR-TKI(s)жІ»з–—еӨұиҙҘзҡ„иҪ¬з§»жҖ§йқһе°Ҹз»ҶиғһиӮәзҷҢжӮЈиҖ…зҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§зҡ„жңҖж–°з»“жһң
SABCS 2022 posterпјҡPD-L1/CTLA-4 еҸҢзү№ејӮжҖ§жҠ—дҪ“KN046иҒ”еҗҲзҷҪиӣӢзҷҪзҙ«жқүйҶҮжІ»з–—иҪ¬з§»жҖ§дёүйҳҙд№іи…әзҷҢзҡ„з–—ж•ҲгҖҒе®үе…ЁжҖ§е’ҢиҖҗеҸ—жҖ§пјҡв…Ўжңҹз ”з©¶зҡ„жңҖз»Ҳз»“жһң
ESMO 2022 posterпјҡKN046(PD-L1/CTLA-4еҸҢзү№ејӮжҖ§жҠ—дҪ“)з”ЁдәҺж—ўеҫҖEGFR-TKIsжІ»з–—еӨұиҙҘзҡ„иҪ¬з§»жҖ§йқһе°Ҹз»ҶиғһиӮәзҷҢ(NSCLC)жӮЈиҖ…зҡ„в…Ўжңҹз ”з©¶
ESMO 2022 posterпјҡKN046(PD-L1/CTLA-4еҸҢзү№ејӮжҖ§жҠ—дҪ“)з”ЁдәҺдёҖзәҝеҢ–з–—жІ»з–—еӨұиҙҘзҡ„иҪ¬з§»жҖ§йқһе°Ҹз»ҶиғһиӮәзҷҢ(NSCLC)жӮЈиҖ…зҡ„в…Ўжңҹз ”з©¶
ESMO 2022 posterпјҡKN046иҒ”еҗҲеҗ«й“ӮеҸҢиҚҜеҢ–з–—дёҖзәҝжІ»з–—йқһе°Ҹз»ҶиғһиӮәзҷҢпјҲNSCLCпјүзҡ„дёӨе№ҙйҡҸи®ҝпјҡдёҖйЎ№ејҖж”ҫж ҮзӯҫгҖҒеӨҡдёӯеҝғзҡ„IIжңҹз ”з©¶
CSCO 2021 posterпјҡKN046иҒ”еҗҲзҷҪиӣӢзҷҪзҙ«жқүйҶҮ/еҗүиҘҝд»–ж»ЁдёҖзәҝжІ»з–—дёҚеҸҜеҲҮйҷӨеұҖйғЁжҷҡжңҹжҲ–иҪ¬з§»жҖ§иғ°и…әеҜјз®Ўи…әзҷҢ(PDAC)зҡ„жңүж•ҲжҖ§е’Ңе®үе…ЁжҖ§
ESMO 2021 posterпјҡKN046иҒ”еҗҲд»‘дјҗжӣҝе°јз”ЁдәҺжІ»з–—жҷҡжңҹдёҚеҸҜеҲҮйҷӨжҲ–иҪ¬з§»жҖ§иӮқз»ҶиғһзҷҢзҡ„еүҚзһ»жҖ§в…ЎжңҹдёҙеәҠиҜ•йӘҢзҡ„еҲқжӯҘз–—ж•ҲеҸҠе®үе…ЁжҖ§з»“жһң
ESMO 2021 posterпјҡKN046иҒ”еҗҲеҗ«й“ӮеҸҢиҚҜеҢ–з–—дҪңдёәжІ»з–—дјҙжңүиҖҗиҚҜжҖ§иҮҙзҷҢй©ұеҠЁеҹәеӣ зӘҒеҸҳзҡ„жҷҡжңҹйқһе°Ҹз»ҶиғһиӮәзҷҢжӮЈиҖ…зҡ„дёҖзәҝз–—жі•
ASCO 2021 posterпјҡKN046иҒ”еҗҲй“Ӯзұ»еҢ–з–—жІ»з–—жҷҡжңҹйқһе°Ҹз»ҶиғһиӮәзҷҢжӮЈиҖ…зҡ„з–—ж•ҲгҖҒе®үе…ЁжҖ§е’ҢиҖҗеҸ—жҖ§зҡ„в…ЎжңҹгҖҒејҖж”ҫгҖҒеӨҡдёӯеҝғз ”з©¶
ASCO 2021 posterпјҡKN046иҒ”еҗҲзҙ«жқүйҶҮ/йЎәй“ӮдёҖзәҝжІ»з–—дёҚеҸҜеҲҮйҷӨеұҖйғЁжҷҡжңҹгҖҒеӨҚеҸ‘жҲ–иҪ¬з§»жҖ§йЈҹз®ЎйіһзҷҢ(ESCC)зҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§
ASCO 2021 posterпјҡKN046иҒ”еҗҲзҷҪиӣӢзҷҪзҙ«жқүйҶҮ/еҗүиҘҝд»–ж»ЁдҪңдёәдёҚеҸҜеҲҮйҷӨзҡ„еұҖйғЁжҷҡжңҹжҲ–иҪ¬з§»жҖ§иғ°и…әеҜјз®Ўи…әзҷҢ(PDAC)дёҖзәҝжІ»з–—зҡ„жңүж•ҲжҖ§е’Ңе®үе…ЁжҖ§
AACR 2021 posterпјҡKN046(PD-L1/CTLA-4еҸҢзү№ејӮжҖ§жҠ—дҪ“)иҒ”еҗҲзҷҪиӣӢзҷҪз»“еҗҲеһӢзҙ«жқүйҶҮжІ»з–—иҪ¬з§»жҖ§дёүйҳҙд№іи…әзҷҢжӮЈиҖ…зҡ„еҲқжӯҘе®үе…ЁжҖ§гҖҒиҖҗеҸ—жҖ§е’Ңз–—ж•Ҳз»“жһң
WCLC 2020 Mini oral reportпјҡKN046еңЁзҪ•и§ҒиғёйғЁиӮҝзҳӨжӮЈиҖ…дёӯзҡ„еҲқжӯҘе®үе…ЁжҖ§е’Ңжңүж•ҲжҖ§з»“жһң
WCLC 2020 posterпјҡKN046з”ЁдәҺжІ»з–—жҷҡжңҹйқһе°Ҹз»ҶиғһиӮәзҷҢ(NSCLC)жӮЈиҖ…зҡ„в…ЎжңҹдёҙеәҠз ”з©¶ж•°жҚ®
ASCO-GI 2020 posterпјҡKN046иҒ”еҗҲж”ҫеҢ–з–—жІ»з–—еӨҚеҸ‘е’ҢиҪ¬з§»жҖ§йЈҹз®ЎйіһзҷҢзҡ„еҲқжӯҘз–—ж•Ҳе’Ңе®үе…ЁжҖ§ж•°жҚ®
ASCO 2020 posterпјҡKN046(PD-L1/CTLA-4еҸҢзү№ејӮжҖ§жҠ—дҪ“)еҜ№ж—ўеҫҖе…Қз–«жЈҖжҹҘзӮ№жҠ‘еҲ¶еүӮжІ»з–—ж— ж•Ҳзҡ„жӮЈиҖ…зҡ„еҲқжӯҘз–—ж•Ҳе’Ңе®үе…ЁжҖ§ж•°жҚ®
ASCO 2019 posterпјҡKN046пјҲжҠ—PD-L1/CTLA4еҸҢзү№ејӮжҖ§жҠ—дҪ“пјүйҰ–ж¬ЎдәәдҪ“иҜ•йӘҢпјҢеңЁжҷҡжңҹе®һдҪ“зҳӨдёӯе®үе…ЁжҖ§гҖҒз–—ж•Ҳе’ҢиҚҜд»ЈеҠЁеҠӣеӯҰзҡ„еҲқжӯҘз»“жһң
KN026* жҳҜеә·е®Ғжқ°з‘һйҮҮз”Ёе…·жңүиҮӘдё»зҹҘиҜҶдә§жқғFcејӮдәҢиҒҡдҪ“е№іеҸ°жҠҖжңҜ(CRIB)ејҖеҸ‘зҡ„HER2еҸҢзү№ејӮжҖ§жҠ—дҪ“пјҢеҸҜеҗҢж—¶з»“еҗҲ HER2зҡ„дёӨдёӘйқһйҮҚеҸ иЎЁдҪҚпјҢеҜјиҮҙHER2дҝЎеҸ·йҳ»ж–ӯпјҢдјҳдәҺжӣІеҰҘзҸ еҚ•жҠ—е’Ңеё•еҰҘзҸ еҚ•жҠ—иҒ”з”Ёзҡ„ж•ҲжһңпјҢеңЁHER2йҳіжҖ§иӮҝзҳӨз»Ҷиғһж Әдёӯе…·еӨҮдјҳж•Ҳзҡ„иӮҝзҳӨжҠ‘еҲ¶дҪңз”ЁгҖӮеҗҢж—¶пјҢKN026еҜ№ HER2дёӯдҪҺиЎЁиҫҫиӮҝзҳӨе’ҢжӣІеҰҘзҸ еҚ•жҠ—жҠ—жҖ§з»Ҷиғһж Әд№ҹжңүжҠ‘еҲ¶дҪңз”ЁгҖӮ

KN026 : жҷ¶дҪ“з»“жһ„
KN026е·ІдәҺ2018е№ҙеҲҶеҲ«иҺ·еҫ—дёӯеӣҪеӣҪ家иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖпјҲNMPAпјүе’ҢзҫҺеӣҪйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖ(FDA)зҡ„жү№еҮҶејҖеұ•дёҙеәҠз ”з©¶гҖӮзӣ®еүҚй’ҲеҜ№дәҢзәҝиғғзҷҢ/иғғйЈҹз®Ўз»“еҗҲйғЁзҷҢгҖҒдёҖзәҝHER2йҳіжҖ§д№іи…әзҷҢгҖҒHER2йҳіжҖ§д№іи…әзҷҢж–°иҫ…зӯүйҖӮеә”з—Үзҡ„еӨҡйЎ№жіЁеҶҢдёҙеәҠз ”з©¶жӯЈеңЁиҝӣиЎҢдёӯгҖӮеҗҢж—¶д№ҹеңЁжҺўзҙўеҸҢжҠ—е’ҢеҸҢжҠ—ADCзҡ„з»„еҗҲз–—жі•гҖӮ
еӨҡйЎ№дёҚеҗҢйҳ¶ж®өдёҙеәҠз ”з©¶з»“жһңиЎЁжҳҺпјҢKN026е…·жңүиүҜеҘҪзҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§пјҢеңЁеӨҡзәҝжҠ—HER2жІ»з–—еҗҺиҝӣеұ•зҡ„HER2йҳіжҖ§д№іи…әзҷҢе’ҢиғғзҷҢжӮЈиҖ…дёӯд»Қ然表зҺ°еҮәжҳҫи‘—зҡ„жҠ—иӮҝзҳӨжҙ»жҖ§гҖӮKN026иҒ”еҗҲеҢ–з–—з”ЁдәҺдёҖзәҝж ҮеҮҶжІ»з–—еӨұиҙҘзҡ„HER2йҳіжҖ§иғғзҷҢпјҲеҢ…жӢ¬иғғ-йЈҹз®Ўз»“еҗҲйғЁи…әзҷҢпјүиҺ·еӣҪ家иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖпјҲNMPAпјүиҚҜе“Ғе®ЎиҜ„дёӯеҝғпјҲCDEпјүжҺҲдәҲзӘҒз ҙжҖ§з–—жі•и®Өе®ҡгҖӮ


SABCS 2023 posterпјҡHER2еҸҢзү№ејӮжҖ§жҠ—дҪ“KN026иҒ”еҗҲеӨҡиҘҝд»–иөӣдёҖзәҝжІ»з–—HER2йҳіжҖ§еӨҚеҸ‘жҲ–иҪ¬з§»д№іи…әзҷҢзҡ„дёӨе№ҙеҚҠйҡҸи®ҝж•°жҚ®
ESMO 2023 posterпјҡKN026иҒ”еҗҲеӨҡиҘҝд»–иөӣз”ЁдәҺHER2йҳіжҖ§ж—©жңҹжҲ–еұҖйғЁжҷҡжңҹд№іи…әзҷҢзҡ„ж–°иҫ…еҠ©жІ»з–—пјҡдёҖйЎ№еҚ•иҮӮгҖҒеӨҡдёӯеҝғгҖҒв…Ўжңҹз ”з©¶
ESMO 2023 posterпјҡKN026иҒ”еҗҲеӨҡиҘҝд»–иөӣдёҖзәҝжІ»з–—HER2йҳіжҖ§еӨҚеҸ‘жҲ–иҪ¬з§»жҖ§д№іи…әзҷҢзҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§дёӨе№ҙйҡҸи®ҝ
SABCS 2022 posterпјҡHER2еҸҢзү№ејӮжҖ§жҠ—дҪ“KN026иҒ”еҗҲеӨҡиҘҝд»–иөӣдёҖзәҝжІ»з–—HER2йҳіжҖ§еӨҚеҸ‘/иҪ¬з§»жҖ§д№іи…әзҷҢзҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§з»“жһң
SABCS 2022 posterпјҡKN026иҒ”еҗҲеӨҡиҘҝд»–иөӣз”ЁдәҺHER2йҳіжҖ§ж—©жңҹжҲ–еұҖйғЁжҷҡжңҹд№іи…әзҷҢзҡ„ж–°иҫ…еҠ©жІ»з–—пјҡдёҖйЎ№еҚ•иҮӮгҖҒеӨҡдёӯеҝғгҖҒв…Ўжңҹз ”з©¶
ASCO 2022 posterпјҡKN026еҗҺзәҝжІ»з–—жҷҡжңҹHER2иЎЁиҫҫзҡ„иғғзҷҢжҲ–иғғйЈҹз®Ўз»“еҗҲйғЁзҷҢзҡ„в…ЎжңҹдёҙеәҠз ”з©¶
ASCO 2021 AbstractпјҡHER2еҸҢзү№ејӮжҖ§жҠ—дҪ“KN026еңЁжҷҡжңҹHER2йҳіжҖ§иғғе’ҢиғғйЈҹз®Ўз»“еҗҲйғЁзҷҢжӮЈиҖ…дёӯзҡ„еҲқжӯҘз–—ж•Ҳ
AACR 2020 posterпјҡдҪҝз”ЁиҪ¬иҜ‘иӮҝзҳӨз”ҹй•ҝжҠ‘еҲ¶жЁЎеһӢеҸҠзҫӨдҪ“иҚҜд»ЈеҠЁеҠӣеӯҰеҲҶжһҗж–№жі•йў„жөӢHER2еҸҢзү№ејӮжҖ§жҠ—дҪ“KN026зҡ„жңүж•ҲеүӮйҮҸ
ASCO 2020 posterпјҡHER2еҸҢзү№ејӮжҖ§жҠ—дҪ“KN026еңЁHER2йҳіжҖ§иҪ¬з§»жҖ§д№іи…әзҷҢжӮЈиҖ…дёӯзҡ„еҲқжӯҘе®үе…ЁжҖ§гҖҒжңүж•ҲжҖ§е’ҢиҚҜд»ЈеҠЁеҠӣеӯҰ(PK)з»“жһң
JSKN003дёәж–°еһӢйқ¶еҗ‘HER2еҸҢиЎЁдҪҚзҡ„жҠ—дҪ“еҒ¶иҒ”иҚҜзү©пјҲADCпјүпјҢз”ұеә·е®Ғжқ°з‘һеҲ©з”Ёзү№жңүзҡ„зі–е®ҡзӮ№еҒ¶иҒ”е№іеҸ°иҮӘдё»з ”еҸ‘пјҡе°ҶжҠ—дҪ“еҲҶеӯҗKN026йҮҚй“ҫзі–еҹәз»ҸиҝҮй…¶еӮ¬еҢ–е’ҢзӮ№еҮ»еҢ–еӯҰеҸҚеә”иҺ·еҫ—DARеҖјзәҰдёә4зҡ„е®ҡзӮ№дҝ®йҘ°жҠ—дҪ“еҒ¶иҒ”зү©гҖӮJSKN003иғҪеӨҹз»“еҗҲиӮҝзҳӨз»ҶиғһиЎЁйқўзҡ„HER2пјҢйҖҡиҝҮз»ҶиғһеҶ…еҗһйҮҠж”ҫжӢ“жү‘ејӮжһ„й…¶в… жҠ‘еҲ¶еүӮпјҢиҝӣиҖҢеҸ‘жҢҘжҠ—иӮҝзҳӨдҪңз”ЁгҖӮ
JSKN003иҫғеҗҢзұ»ADCиҚҜзү©е…·жңүжӣҙеҘҪзҡ„иЎҖжё…зЁіе®ҡжҖ§гҖҒжӣҙејәзҡ„ж—Ғи§ӮиҖ…жқҖдјӨж•Ҳеә”пјҢжңүж•Ҳең°жү©еӨ§дәҶжІ»з–—зӘ—гҖӮдёҙеәҠеүҚз ”з©¶жҳҫзӨәпјҢJSKN003еңЁHER2й«ҳиЎЁиҫҫе’ҢдҪҺиЎЁиҫҫз»ҶиғһпјҲCDX+PDXжЁЎеһӢпјүдёӯеқҮжңүиүҜеҘҪзҡ„е®үе…ЁжҖ§е’Ңз–—ж•ҲгҖӮ

JSKN003зӣ®еүҚеңЁдёӯеӣҪе’ҢжҫіеӨ§еҲ©дәҡжӯЈеңЁиҝӣиЎҢеӨҡйЎ№дёҚеҗҢйҳ¶ж®өзҡ„дёҙеәҠз ”з©¶пјҢз ”з©¶з»“жһңжҳҫзӨәдәҶиүҜеҘҪзҡ„иҖҗеҸ—жҖ§е’Ңе®үе…ЁжҖ§пјҢеңЁж—ўеҫҖжҺҘеҸ—иҝҮеӨҡзәҝзі»з»ҹжҖ§жҠ—иӮҝзҳӨжІ»з–—еҗҺзҡ„еӨҡз§Қжҷҡжңҹе®һдҪ“зҳӨжӮЈиҖ…дёӯпјҢе°Өе…¶жҳҜеңЁHER2иЎЁиҫҫзҡ„д№іи…әзҷҢгҖҒй“ӮиҖҗиҚҜеҚөе·ўзҷҢд»ҘеҸҠHER2й«ҳиЎЁиҫҫзҡ„е…¶д»–е®һдҪ“зҳӨжӮЈиҖ…дёӯз–—ж•ҲжҳҺжҳҫгҖӮжІ»з–—HER2дҪҺиЎЁиҫҫд№іи…әзҷҢгҖҒй“ӮиҖҗиҚҜеҚөе·ўзҷҢгҖҒHER2йҳіжҖ§д№іи…әзҷҢйҖӮеә”з—Үе·ІеңЁеӣҪеҶ…иҝӣе…Ҙв…ўжңҹдёҙеәҠйҳ¶ж®өгҖӮ

ESMO 2024 posterпјҡJSKN003пјҲдёҖз§ҚHER2йқ¶еҗ‘жҠ—дҪ“еҒ¶иҒ”иҚҜзү©пјүжІ»з–—й“ӮиҖҗиҚҜеҚөе·ўзҷҢжӮЈиҖ…пјҡдёӨйЎ№з ”з©¶зҡ„жұҮжҖ»еҲҶжһҗ
ESMO 2024 posterпјҡJSKN003жІ»з–—жҷҡжңҹHER2йҳіжҖ§пјҲIHC 3+пјүе®һдҪ“зҳӨпјҲд№іи…әзҷҢйҷӨеӨ–пјүжӮЈиҖ…зҡ„е®үе…ЁжҖ§е’Ңжңүж•ҲжҖ§
ASCO 2024 posterпјҡJSKN003еңЁжҷҡжңҹе®һдҪ“зҳӨжӮЈиҖ…дёӯзҡ„е®үе…ЁжҖ§гҖҒиҚҜд»ЈеҠЁеҠӣеӯҰе’Ңз–—ж•ҲиҜ„дј°пјҡв… /в…ЎжңҹдёҙеәҠз ”з©¶
AACR 2024 posterпјҡJSKN003з”ЁдәҺжІ»з–—жҷҡжңҹ/иҪ¬з§»жҖ§е®һдҪ“зҳӨзҡ„е®үе…ЁжҖ§е’Ңз–—ж•ҲпјҡдёҖйЎ№йҰ–ж¬ЎеңЁдәәдҪ“дёӯиҝӣиЎҢзҡ„гҖҒеүӮйҮҸйҖ’еўһе’ҢеүӮйҮҸжү©еұ•гҖҒеӨҡдёӯеҝғгҖҒејҖж”ҫзҡ„Iжңҹз ”з©¶
JSKN016жҳҜеә·е®Ғжқ°з‘һеҲ©з”Ёзү№жңүзҡ„зі–е®ҡзӮ№еҒ¶иҒ”е№іеҸ°иҮӘдё»з ”еҸ‘зҡ„еҸҢзү№ејӮжҖ§жҠ—дҪ“еҒ¶иҒ”иҚҜзү©пјҲADCпјүпјҢйқ¶еҗ‘HER3пјҲHuman epidermal growth factor receptor 3пјҢдәәиЎЁзҡ®з”ҹй•ҝеӣ еӯҗеҸ—дҪ“3пјүе’ҢTROP2пјҲTrophoblast cell surface antigen 2пјҢдәәж»Ӣе…»з»ҶиғһиЎЁйқўжҠ—еҺҹ2пјүгҖӮ
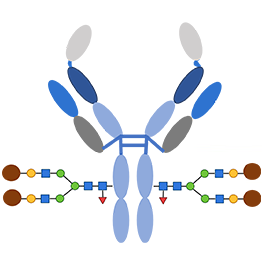
JSKN016дёҺиӮҝзҳӨз»ҶиғһиЎЁйқўTROP2е’Ң/жҲ–HER3з»“еҗҲеҗҺпјҢйҖҡиҝҮйқ¶зӮ№д»ӢеҜјзҡ„еҶ…еҗһдҪңз”Ёиҝӣе…ҘеҲ°жә¶й…¶дҪ“дёӯпјҢйҮҠж”ҫеҮәе…·жңүз»ҶиғһжҜ’жҖ§зҡ„жӢ“жү‘ејӮжһ„й…¶IжҠ‘еҲ¶еүӮ (TOPIi)пјҢиҝӣиҖҢиҜұеҜјTROP2е’Ң/жҲ–HER3йҳіжҖ§зҡ„иӮҝзҳӨз»ҶиғһеҮӢдәЎпјҢжӯӨеӨ–иҜҘжҠ‘еҲ¶еүӮиҝҳеҸҜд»Ҙз©ҝйҖҸз»ҶиғһиҶңиҝӣе…ҘеҲ°жҠ—еҺҹйҳҙжҖ§зҡ„иӮҝзҳӨз»ҶиғһдёӯеҸ‘жҢҘж—Ғи§ӮиҖ…ж•Ҳеә”гҖӮдёӨиҖ…зҡ„еҸ еҠ дҪңз”ЁеҸҜд»Ҙжңүж•ҲжҠ‘еҲ¶иӮҝзҳӨз»Ҷиғһзҡ„з”ҹй•ҝгҖӮ
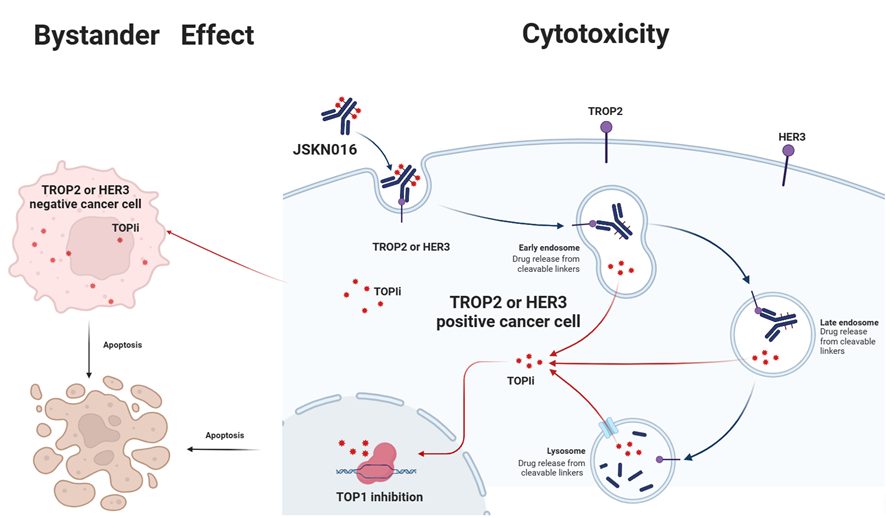
зӣ®еүҚJSKN016жӯЈеңЁдёӯеӣҪејҖеұ•еӨҡйЎ№дёҙеәҠз ”з©¶гҖӮ

JSKN033жҳҜеә·е®Ғжқ°з‘һиҮӘдё»з ”еҸ‘зҡ„е…ЁзҗғйҰ–дёӘжҠ—дҪ“еҒ¶иҒ”иҚҜзү©е’Ңе…Қз–«жЈҖжҹҘзӮ№жҠ‘еҲ¶еүӮзҡ„й«ҳжө“еәҰзҡ®дёӢжіЁе°„еӨҚж–№еҲ¶еүӮпјҢз”ұJSKN003е’ҢжҒ©жІғеҲ©еҚ•жҠ—пјҲKN035пјүз»„жҲҗгҖӮ
JSKN003зӣёжҜ”еҗҢзұ»ADCиҚҜзү©е…·жңүжӣҙеҘҪзҡ„иЎҖжё…зЁіе®ҡжҖ§гҖҒжӣҙејәзҡ„ж—Ғи§ӮиҖ…жқҖдјӨж•Ҳеә”пјҢжңүж•Ҳең°жү©еӨ§дәҶжІ»з–—зӘ—пјҢзӣ®еүҚJSKN003жӯЈеңЁжҫіеӨ§еҲ©дәҡе’ҢдёӯеӣҪејҖеұ•еӨҡйЎ№дёҙеәҠз ”з©¶пјҢжІ»з–—HER2дҪҺиЎЁиҫҫд№іи…әзҷҢгҖҒй“ӮиҖҗиҚҜеҚөе·ўзҷҢгҖҒHER2йҳіжҖ§д№іи…әзҷҢзҡ„йҖӮеә”з—Үе·ІеңЁеӣҪеҶ…иҝӣе…Ҙв…ўжңҹдёҙеәҠйҳ¶ж®өгҖӮжҒ©жІғеҲ©еҚ•жҠ—жҳҜе…ЁзҗғйҰ–дёӘдё”зӣ®еүҚе”ҜдёҖиҺ·жү№дёҠеёӮзҡ„зҡ®дёӢжіЁе°„PD-(L)1жҠ—дҪ“гҖӮеҹәдәҺе…¶зӢ¬зү№и®ҫи®ЎпјҢеңЁжңүж•ҲжҖ§гҖҒе®үе…ЁжҖ§гҖҒдҫҝеҲ©жҖ§е’Ңдҫқд»ҺжҖ§ж–№йқўе…·жңүдјҳеҠҝпјҢжӮЈиҖ…ж— йңҖиҝӣиЎҢйқҷи„үж»ҙжіЁпјҢиғҪжһҒеӨ§ең°иҠӮзңҒеҢ»з–—иө„жәҗпјҢзӣ®еүҚжӯЈеңЁдёӯеӣҪгҖҒзҫҺеӣҪе’Ңж—Ҙжң¬ејҖеұ•еӨҡдёӘиӮҝзҳӨйҖӮеә”з—Үзҡ„дёҙеәҠз ”з©¶пјҢеӨҡдёӘйҖӮеә”з—Үе·Іиҝӣе…ҘжіЁеҶҢ/в…ўжңҹдёҙеәҠгҖӮJSKN033з»“еҗҲе…Қз–«жІ»з–—е’ҢADCзҡ„дјҳеҠҝиҖҢжҸҗй«ҳз–—ж•ҲпјҢ并йҖҡиҝҮз»ҷиҚҜйҖ”еҫ„зҡ„дјҳеҢ–жҸҗеҚҮе®үе…ЁжҖ§е’ҢдҫҝжҚ·жҖ§гҖӮзӣ®еүҚJSKN033жӯЈеңЁдёӯеӣҪе’ҢжҫіеӨ§еҲ©дәҡејҖеұ•з”ЁдәҺжІ»з–—жҷҡжңҹжҲ–иҪ¬з§»жҖ§е®һдҪ“зҳӨзҡ„в… /в…ЎжңҹдёҙеәҠз ”з©¶гҖӮ

SITC 2024 posterпјҡHER2еҸҢзү№ејӮжҖ§жҠ—дҪ“еҒ¶иҒ”иҚҜзү©дёҺPD-L1жҠ‘еҲ¶еүӮзҡ„еҲӣж–°еһӢзҡ®дёӢжіЁе°„й«ҳжө“еәҰеӨҚж–№еҲ¶еүӮJSKN033пјҡз”ЁдәҺжІ»з–—жҷҡжңҹе®һдҪ“зҳӨ
KN019 дёҺиҙқжӢүиҘҝжҷ®(BelataceptпјҢиӢұж–Үе•Ҷе“ҒеҗҚпјҡNulojix®)зӣёеҗҢзҡ„ж°Ёеҹәй…ёеәҸеҲ—пјҢжҜ”иҮӘдҪ“е…Қз–«з–ҫз—…зҡ„йҮҚзЈ…иҚҜзү©Orenciaжҙ»жҖ§ејә10еҖҚпјҢдё”е®үе…ЁжҖ§иүҜеҘҪгҖӮKN019е·ІиҺ·еҫ—дёӯеӣҪеӣҪ家иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖйўҒеҸ‘зҡ„дёҙеәҠжү№д»¶пјҢејҖеҸ‘з”ЁдәҺиӮҫ移жӨҚжҺ’ж–ҘеҸҚеә”е’Ңзұ»йЈҺж№ҝе…іиҠӮзӮҺзӯүиҮӘиә«е…Қз–«жҖ§йҖӮеә”з—Үзҡ„йў„йҳІдёҺжІ»з–—гҖӮеә·е®Ғжқ°з‘һиҝҳи®ЎеҲ’з ”з©¶KN019йҷҚдҪҺиӮҝзҳӨе…Қз–«еёҰжқҘзҡ„еүҜдҪңз”Ёж–№йқўзҡ„дёҙеәҠеә”з”ЁгҖӮ
KN019 : жҷ¶дҪ“з»“жһ„
иҙқжӢүиҘҝжҷ®жҳҜдёҖз§Қе·ІиҺ·жү№дёҠеёӮзҡ„е…Қз–«жҠ‘еҲ¶еүӮпјҢз”ЁдәҺжҲҗе№ҙжӮЈиҖ…йў„йҳІиӮҫи„Ҹ移жӨҚжҺ’ж–ҘеҸҚеә”гҖӮиҙқжӢүиҘҝжҷ®зҡ„дјҳи¶Ҡз–—ж•Ҳе·ІеңЁдёҙеәҠиҜ•йӘҢзҡ„й•ҝжңҹи·ҹиёӘз ”з©¶дёӯеҫ—еҲ°дәҶе……еҲҶзҡ„иҜҒе®һгҖӮ
иҙқжӢүиҘҝжҷ®жҳҜеҹәдәҺйҳҝе·ҙиҘҝжҷ®пјҲAbataceptпјҢиӢұж–Үе•Ҷе“ҒеҗҚпјҡ Orencia®)иҝӣиЎҢж”№иҝӣзҡ„иҚҜзү©пјҢе…¶иҚҜж•ҲжӣҙејәгҖӮйҳҝе·ҙиҘҝжҷ®иў«жү№еҮҶз”ЁдәҺзұ»йЈҺж№ҝжҖ§е…іиҠӮзӮҺгҖҒзү№еҸ‘жҖ§е…іиҠӮзӮҺе’Ңзүӣзҡ®зҷЈе…іиҠӮзӮҺзҡ„жІ»з–—гҖӮ
иҙқжӢүиҘҝжҷ®зҡ„иӣӢзҷҪиҙЁз»“жһ„е…·жңүеӨҚжқӮзҡ„дёҺеҠҹиғҪзӣёе…ізҡ„зі–еҹәеҢ–гҖӮ еҲ°зӣ®еүҚдёәжӯўпјҢе…ЁзҗғиҝҳжІЎжңүе…¶д»–е…¬еҸёиғҪеӨҹејҖеҸ‘еҮәиҙқжӢүиҘҝжҷ®з”ҹзү©зұ»дјјиҚҜгҖӮKN019з”ҹдә§еҫ—зҺҮй«ҳпјҢиӣӢзҷҪзҡ„дёҖзә§з»“жһ„гҖҒй«ҳзә§з»“жһ„е’Ңзҝ»иҜ‘еҗҺдҝ®йҘ°дёҺеҺҹз ”иҚҜй«ҳеәҰзӣёдјјпјҢиҚҜзҗҶжҜ’зҗҶз ”з©¶з»“жһңд№ҹдёҺеҺҹз ”иҚҜй«ҳеәҰдёҖиҮҙпјҢеӣ жӯӨжңүжңӣжҲҗдёәиҙқжӢүиҘҝжҷ®зҡ„йҰ–дёӘз”ҹзү©зұ»дјјиҚҜгҖӮеҗҢж—¶пјҢжҲ‘们д№ҹдјҡж”№иүҜеҲ¶еүӮпјҢз”ЁдәҺеӨҡдёӘе…Ёж–°йҖӮеә”з—Үзҡ„дёҙеәҠејҖеҸ‘гҖӮ